
GS1 UDI 服务平台
 400-7000-690转3
400-7000-690转3

 400-7000-690转3
400-7000-690转3


GS1是全球通行的UDI发码机构

GS1标准体系是唯一满足全球UDI要求的标准体系

全球超过250万家企业选择GS1国际标准,涉及25个领域 GS1标准及应用极大提高了全球供应链效率

覆盖全球150个国家和地区
医疗器械唯一标识:Unique Device ldentifier(UDI)






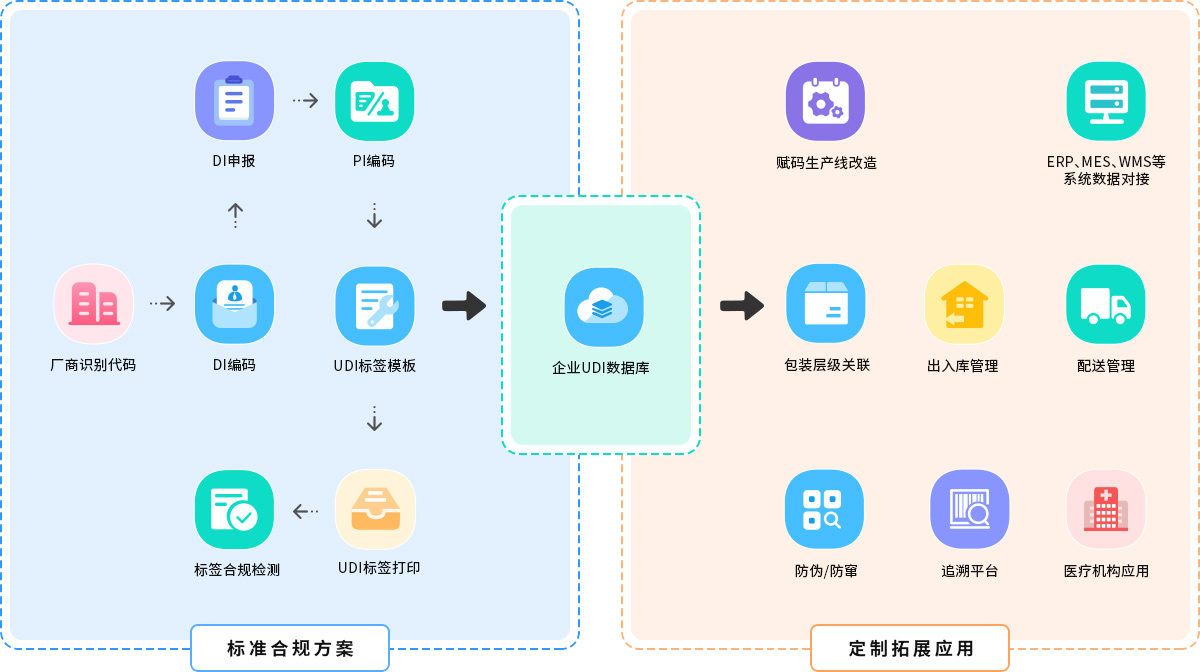
一站式UDI解决方案

UDI法规咨询及培训

UDI合规申报

UDI编码发码

UDI标签及打印
UDI数据服务

基于UDI的生产线改造

UDI企业数据库

UDI追溯

经营企业UDI管理

基于UDI的经营企业进销存

国家药监局印发:《医疗器械唯一标识系统规则》《关于印发医疗器械唯一标识系统试点工作方案的通知(药监综械注〔2019〕56号)》《关于做好第一批实施医疗器械唯一标识工作有关事项的通告(2019年第72号)》
国家药监局 国家卫生健康委 国家医保局印发:《关于深入推进试点做好第一批实施医疗器械唯一标识工作的公告(2020年 第106号)》
国家药监局国家卫生健康委国家医保局印发:《关于做好第二批实施医疗器械唯一标识工作的公告(2021年第114号)》
2022年6月1日起,全部第三类医疗器械应当具有医疗器械唯一标识
简单、高效、官方出品
 92%的医疗器械企业选择GS1标准,行业实践经验丰富
92%的医疗器械企业选择GS1标准,行业实践经验丰富
 官方团队提供全程指导,一对一制定UDI合规方案、实施培训
官方团队提供全程指导,一对一制定UDI合规方案、实施培训
 GS1官方定期联合监管部门、医疗器械龙头企业及医院举办培训活动,进行政策指导和案例分享
GS1官方定期联合监管部门、医疗器械龙头企业及医院举办培训活动,进行政策指导和案例分享

发码机构直接发码,企业无需多方申请,一站式实现UDI合规全流程

深入贯彻药监局“UDI数据规范存储、方便调用”要求,为企业搭建私有UDI数据库,提供无限量数据存储,且方便数据调用、保证数据安全

直接对接药监局数据库及中国商品信息服务平台,DI编码一键申报、通报,满足药监局和市场监管局产品信息备案规定

平台可实现DI编码自动化,并内置自动合规校验工具,确保编码合规

拖拽式标签设计上手即会,自动接口,手动/自动打印设备直连输出全兼容

平台具高拓展性,开放接口,满足企业ERP、MES、其他相关平台上的系统级对接,打通生产、储运、管理、流通追溯各环节

企业无需组建编码团队,便捷化UDI管理,引导式操作,“更低成本、更快速度、更简操作”完成UDI赋码全流程

即满足医疗器械生产企业、经营企业UDI合规实施, 也满足备案数据一键上传上级监管平台
更便捷服务企业
分中心
覆盖率